전반적인 항암제에 대한 정보를 잘 정리해 놓은 논문이다.
https://yesme.kiom.re.kr/Trend/articles/do_print/tableid/tech/page/6/id/1330
항암제 내성을 극복하기 위한 최신 연구 동향
신유진 / 생물학. 생명공학 컨설턴트 1. 서론 2. 본론 3. 결론 4. 참고문헌 암은 환경의 변화, 인구 고령화 및 생활양식의 변화 등으로 인해 사망률이 매년 지속해서 증가하는 질병이다. 전 세계적
yesme.kiom.re.kr
항암제 내성을 극복하기 위한 최신 연구 동향
신유진 / 생물학. 생명공학 컨설턴트
[목 차]
1. 서론
2. 본론
2.1 면역항암제의 개발
2.2 차세대 치료제의 개발
2.3 항암제의 병용요법
2.4 바이오마커의 개발
2.5 천연물 유래의 새로운 항암 소재 개발
2.6 새로운 약물전달시스템의 개발
3. 결론
4. 참고문헌
[요약문]
암은 환경의 변화, 인구 고령화 및 생활양식의 변화 등으로 인해 사망률이 매년 지속해서 증가하는 질병이다. 전 세계적으로 5대 사망원인 중 하나이며 우리나라에서는 사망원인의 1위를 차지하는 질병이다[1]. 암의 치료는 외과적 수술, 방사선 치료, 약물 요법으로 시행되고 있다. 약물 요법의 경우 1세대 화학항암제(chemotherapy)를 시작으로 2세대 표적항암제 (targeted drugs therapy)가 개발되어 현재까지 가장 많이 사용되고 있지만, 항암제 내성이라는 큰 문제에 직면해있다. 항암제 내성을 극복하기 위해 3세대 면역항암제(immunotherapy)의 개발, 기존 약물의 문제점을 보완한 차세대 치료제(next generation drug)의 개발, 기존의 약물과의 병용요법(combination therapy), 병의 유무를 구분하거나 치료 반응을 예측할 수 있는 표시자인 바이오마커(biomarker)의 개발, 천연물 유래의 새로운 항암 물질 개발, 치료 효능의 극대화를 위하여 새로운 약물전달시스템을 개발하는 등의 다양한 접근방식이 진행 중이다. 본 글에서는 최근 진행되고 있는 항암제 내성을 극복하기 위한 연구 동향에 대해 논의한다.
1. 서론
1940년대 후반기부터 사용된 화학항암제는 보통 DNA damage를 일으켜 세포를 죽이는 방식으로 암세포만이 아닌 건강한 정상 세포를 함께 공격함으로써 치료의 한계점(toxicity)이 있다. 2000년대 들어 사용된 표적항암제는 암세포에만 존재하는 특정 표적 단백질을 공격한다는 이점이 있지만 같은 암종이라도 환자에게 특정 표적 인자가 없으면 복용할 수 없다는 단점이 있다. 공통으로 두 세대의 항암제에 대한 내성의 발생으로 약물의 사용이 여전히 제한적이다.
내성의 발생은 크게 두 가지로 분류되는데 초기부터 약물에 대한 내성을 가진 요인이 암세포에 존재하여 약물이 반응하지 않는 선천적인 내성(intrinsic resistance)과 약물 처리가 암의 치료에 효과를 보이다 약물의 지속적 치료 과정에서 변성(mutations)이 발생하거나 다른 신호 전달 체계와의 상호작용으로 단순한 단백질이나 효소의 작용 억제만으로는 약물이 더는 반응을 하지 않게 되는 후천적인 내성(acquired resistance)이 있다.
화학항암제와 표적항암제의 내성은 약물의 표적 단백질의 발현 변화 및 변성, prosurvival 신호 경로의 활성, 유전자 손상 회복 시스템(DNA repair system)의 증가, 세포 사멸(apoptosis) 신호 전달 유도의 실패 등 다양한 방식으로 진행된다[2]. 화학항암제의 경우 약물 및 암의 종류에 따라 DNA, topoisomeras나 tublin을 타겟으로 하여 약물의 저항 기전이 표적 단백질의 발현 변화나 변성, anti-apoptosis 단백질의 증가가 내성 기전에 영향을 미친다고 알려져 있고, 특정 단백질을 타겟으로 하는 표적항암제의 내성 기전 역시 단백질의 변성 및 발현 변화, anti-apoptosis 기전의 영향 등이 보고된다(표 1).
표 1. 내성이 발생한 대표적 화학 및 표적항암제[2]


2. 본론
기존 약물에 대한 내성을 극복하고 최종 목표인 암의 정복을 위한 다양한 시도가 이뤄지고 있다. 각 연구 방법 및 진행 상황을 논의하고자 한다.
2.1 면역항암제의 개발
2010년 FDA 승인을 받은 전립선암 면역치료 백신 sipuleucel-T (Provenge®)의 개발 이후로 최근까지 가장 빠른 속도로 개발이 진행되고 있는 항암제 연구는 면역항암제의 개발이다. 기존의 항암제 내성을 극복하는 방법으로 환자의 면역체계를 직접 주입함으로써 내성에 자유로운 약물 개발의 중요성이 주목받았다. 현재까지 20건이 넘는 면역치료제가 FDA에 승인을 받았고, 1,100여 건이 넘는 임상 시험이 진행 중으로 빠른 속도로 개발이 진행 중인 분야이다[3; ClinicalTrials.gov]. 면역항암제는 치료 기전에 따라 면역 체크포인트 조절자(immune checkpoint modulators), 면역 세포 치료제(immune cell therapy), 치료용 항체(therapeutic antibodies), 백신(vaccine), 면역계 조절자(immune system modulators)로 나뉜다[4].
2011년 FDA 승인을 받은 최초의 체크포인트 저해제는 흑색종의 B7-1 (CD80)/B7-2 (CD86)와 T cell의 cytotoxic T-lymphocyte–associated antigen 4 (CTLA-4)의 결합을 저해하여 암세포를 사멸하는 CTLA-4 억제제 ipilimumab (yervoy®; 항체치료제)이다. CTLA-4 억제제보다 부작용과 효과 면에서 우수함을 보인 programmed cell death protein 1 (PD-1)이나 PD-ligand 1 (PD-L1)의 면역 체크포인트 저해제가 면역항암제 개발에서 현재 가장 활발하게 연구되고 있는 분야이다. 암세포의 PD-L1과 T cell의 PD-1의 결합을 저해하여 T cell이 암세포를 발견 그리고 사멸하게 하는 방법이다. PD-1 억제제는 pembrolizumab (keytruda®; 흑색종, 비소세포 폐암의 항체치료제)과 nivolumab (opdivo®; 흑색종, 비소세포폐암, 신장암의 항체치료제)이 FDA의 승인을 받았다. 첫 PD-L1 억제제 atezolizumab (tecentriq®; 항체치료제)는 백금기반의 화학항암제 치료 중이거나 증상이 악화된 전이성 비소세포폐암 환자를 위한 치료제로 FDA의 승인을 받았다. 또한 atezolizumab는 FDA에 승인을 받은 치료제를 처방했지만 증상이 악화된 epidermal growth factor recepter (EGFR)이나 anaplastic lymphoma kinase (ALK) 유전자 이상을 나타내는 전이성 비소세포 환자들에게도 사용한다[5]. Durvalumab (imfinzi®; 방광암 항체치료제)은 PD-L1 발현의 여부를 측정하는 ventana PD-L1 (AP263) IHC assay와 함께 2017년 5월 FDA 승인을 받은 PD-L1 저해제이다[6](그림 1). 또한 전이성 흑색종 환자에 ipilimumab과 nivolumab의 병용치료요법이 ipilimumab의 단일치료요법보다 progression free survival의 생존기간이 상당히 증가함을 보였고, 2015년 ipilimumab과 nivolumab의 병용치료요법은 BRAF wild-type 흑색종 환자의 치료제로 FDA승인을 받았다[7]. 그 외 직접적 결합을 통한 T 세포의 활성화는 PD-1과 같은 carcinoembryonic antigen-related cell adhesion molecule 1 (CEACAM1), lymphocyte activation gene 3 (LAG3), T cell membrane protein-3 (TIM-3) 등의 면역체크포인트를 억제하는 방식과 보조활성인자 CD137, CD27, CD40, OX40 등을 자극하는 방식의 면역항암제 개발이 진행되고 있다[8]. T 세포의 간접적 활성화 방법으로는 PD-L1과 같은 면역억제 기능을 유발하는 인자 indoleamine-pyrrole 2,3-dioxygenase (IDO), myeloid-derived suppressor cells (MDSC), tumor-associated macrophages (TAM), regulatory T cells (Treg)을 억제하거나 화학요법 및 방사선요법을 통해 면역성 세포사멸을 유도하는 방식이 진행되고 있다[9].
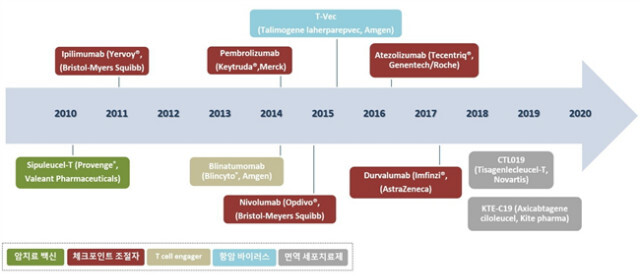
그림 1. 면역항암제의 FDA승인 및 개발 상황
Chimeric antigen receptor (CAR) T 세포 치료제는 개인 맞춤(precision therapeutic) 의료 신약 중의 하나로 급부상하는 있는 약물이다. 환자에서 채취한 T cell을 암세포에 대한 사멸을 높이도록 재구성하여 안전하고 효과적으로 인체 내로 유입하여 암세포를 발견 그리고 사멸시킬 수 있는 약물로 개발하여 다양한 암의 치료에 이용하기 위한 연구가 활발히 진행되고 있다[10]. Novartis의 CTL019 (Tisagenlecleucel-T)는 난치성 또는 재발성 B세포림프종 환자의 T 세포를 추출 후 DNA를 재구성하여 환자에게 주입하는 방식이며 Kite pharma의 KTE-C19 (Axicabtagene ciloleucel)는 악성 B세포의 표면의 CD19를 표적으로 하는 CAR-T 세포 치료제로 두 약물 다 올해 FDA 승인이 기대된다.
2.2 차세대 치료제의 개발
항암제에 대한 내성 발생을 극복하기 위해 기존 약물의 문제점을 보완한 차세대 치료제 개발이 진행되고 있다.
대부분의 암 환자들에서 공통으로 활성화가 관찰되는 신호 경로 중 하나는 phosphatidylinositol 3-kinase catalytic subunit-α (PIK3CA)/AKT/mammalian target of rapamycin (mTOR)이다[11]. 따라서 이를 표적으로 하는 저분자 화합물 억제제(small molecule inhibitors)의 개발은 일찍부터 시작되었다. 1세대 mTORC1 억제제인 rapamycin과 이를 보완한 2세대 mTOR ATP competitive 억제제인 AZD8055가 있다. 하지만 MCF-7 유방암 세포에서 rapamycin의 경우 mTOR의 FKBP12-rapamycin-binding domain (FRB domain)의 A2034V와 F2108L의 변성이 그리고 AZD8055의 경우 kinase domain에 M2327I의 변성이 관찰되어 이들의 약물 처리에 대한 저항성 문제가 대두되었다. 현재 1/2세대의 저항성을 극복할 3세대 mTOR 저해제는 기존 두 약물의 결합 자리의 상호작용을 이용해 변성을 억제하는 방식으로 진행되고 있다[12](그림 2).
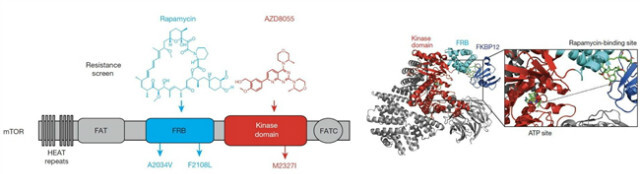
그림 2. mTOR 단백질의 1/2 세대 표적 항암제에 대한 저항성 및 3세대 약물 개발[12]
전이성 비소세포성 폐암을 유발하는 인자 EGFR을 표적으로 하는 약물은 1세대 EGFR Tysoine Kinase Inhibitor (TKI)의 약물은 erlotinib (tarceva®)과 gefitinib (iressa®)으로 4가지 EGFR 중 ErbB-1만을 선택적으로 차단하는 약물로 획득 내성에 의한 돌연변이(T790M)가 환자에게 발견되어 사용에 제한이 있다. 2세대 EGFR TKI인 afatinib (gilotrif®)은 4가지의 ErbB family를 모두를 차단하여 비가역적으로 내성의 위험을 억제하는 장점을 보여주었지만 독성 및 1세대 TKI의 한계를 넘어서지 못하여 차세대 EGFR TKI의 개발이 활발하게 진행되고 있다. 차세대 EGFR TKI 치료제는 EGFR T790M 변이가 있는 전이성 비소세포성 폐암 환자를 대상으로 개발한 약물로 osimertinib (tarisso®), olmutinib (HM61713), CO-1686이 대표적 개발 약물로 Astrazeneca의 osimertinib은 올 3월에 FDA 승인을 받았고, 한미약품의 olmutinib은 임상 3상을 진행 중이다[13].
2.3 항암제의 병용요법
기존의 항암제에 대한 내성의 발생을 극복하기 위한 하나의 방법으로 각 항암제의 병용요법으로 치료를 극대화하는 방법이 있다.
대장암의 표적치료제의 경우 EGFR의 활성을 저해하는 단일클론 항체 cetuximab (erbitux®)과 panitumumab (vectibix®)이 가장 많이 사용되는 치료제이다. 둘 다 EGFR의 발현이 있는 약 50%의 대장암 환자 치료제로 사용하고 전체 대장암 환자의 10~20%에서 효과를 보인다. KRAS wild type을 가진 40~60%의 환자에게 처방하면 약 50%의 반응을 보인다. 하지만 50%의 환자에게는 반응하지 않는 것으로 새로운 표적 및 새로운 바이오마커(예를 들면 BRAF, NRAS, PTEN, PI3K 등)의 발굴에 대한 연구가 지속되고 있다[14]. 최근 연구에 의하면 KRAS wild type tumour grafts에서 cetuximab의 선천적 내성을 가진 경우 FGFR (fibroblast growth factor receptor) 1 amplification과 ERBB2, EGFR, FGFR, PDGFR1, MAP2K1 유전자 변이가 관찰되었으며 후천적 내성의 경우 IRS2의 변성이 발견되었다. 각각의 유전자의 amplification이나 변성된 tumour graft 모델에서 단백질을 타겟으로 하는 약물과 cetuximab과의 병용요법의 효과를 비임상 실험으로 확인하였다[15].
유방암의 경우 30% 이상의 환자가 human epidermal growth factor receptor type 2 (HER2) 단백질의 발현이 증가한 경우로 HER2를 표적으로 하는 치료제(예를 들면 trastuzumab; 인체화 단일클론 항체)가 개발되어 널리 사용되었다. 하지만 HER2의 작용 억제만으로는 내성의 발생을 막을 수 없어 HER2 유방암의 내성 기전에 영향을 미치는 다양한 신호 전달 체계와의 상호작용 (예를 들면 PI3K/AKT/mTOR)을 억제함으로써 치료 효과를 극대화하는 연구가 이뤄지고 있다[16].
앞서 언급한 면역 체크포인트 항암제 간의(anti-PD-1/L1와 anti-CTLA4) 병용요법뿐만 아니라 단일 체크포인트 항암제와 보조활성인자 약물과의 병용요법, 화학항암제, 표적항암제 또는 방사선 요법과의 다양한 병용요법 역시 진행되고 있다[3,17].
2.4 바이오마커의 개발
면역항암제 개발과 더불어 중요시되는 기술은 바이오마커의 개발이다. 바이오마커가 제시되지 않았던 약물의 개발이 실패한 경우가 많았던 과거에 비해 부작용 예방 및 환자군 설정을 용의하게 하는 바이오마커 개발 시장은 빠른 성장세를 보인다. 바이오마커의 발굴은 환자별로 최적의 치료방법을 마련하여 위험도를 최소화하여 환자별 맞춤 치료에 활용함으로써 기존의 약물에 내성을 보인 환자군의 위험도를 최소화할 수 있는 장점이 있다.
대장암과 폐암에서 KRAS, 흑색종과 갑상선암에서 BRAF, 대장암, 흑색종, 폐암에서 NRAS 등 유전자형 분석은 특정 환자군 설정 및 치료제 선정에 효과를 높이고 있다. 앞서 언급한 anti-PD-1 면역항암제 pembrolizumab과 nivolumab의 경우 기전이나 효능 면에서 유사한 점이 많으나 바이오마커의 유무에 차이가 있다. Nivolumab는 PD-L1의 발현율과 상관없이 FDA 승인을 받았고, pembrolizumab은 PD-L1의 발현이 50% 이상인 비소세포성 폐암 환자에게 투여하도록 허가를 받았다[18]. PD-L1의 발현율이 믿을만한 바이오마커인지에 대한 논란은 많으나 현재 적용할 수 있는 가장 유망한 바이오마커이다[19].
최근 FDA는 암종에 상관없이 특정 바이오마커의 존재 여부만으로 약물을 처리하는 방안을 처음으로 승인하였다[20]. 앞서 언급한 anti-PD-1 항체 치료제 pembrolizumab은 microsatellite instability-high (MSI-H)나 mismatch repair deficient (dMMR)를 가진 환자를 대상으로 사용이 허가되었다. Pembrolizumab은 면역세포와 암세포에서 발견되는 PD-1/PD-L1의 세포 경로를 표적으로 하는 약물로 2017년 이전에는 특정 환자에게만 국한되었으나 이번 승인으로 MSI-H/dMMR이 공통으로 발견되는 대장암, 위암, 자궁내막암이나 많이 발견되지 않은 암종인 유방암, 전립선암, 갑상선암 등의 치료에도 적용할 수 있게 되었다.
2.5 천연물 유래의 새로운 항암 소재 개발
천연물 유래의 항암제(예를 들면 paclitaxel, vinblastine, camptothecin 등)의 개발은 효과적인 암 환자 치료에 중요한 역할을 해왔다. 천연물질에서 활성성분을 추출하여 의약품으로 개발하는 방식으로 천연물 약재는 오랜 기간 항암제의 소재 및 민간요법 등으로 사용됐다. 항암제 내성의 발생을 극복하기 위하여 식물, 해양, 천연물 등 다양한 생물 자원이 항암제 소재로 개발되는 등 그 중요성이 확대되고 있다.
폐암의 표적항암제 EGFR-TKI 저해제인 gefitinib의 획득 내성 표적 단백질(AXL)의 분해를 촉진하는 yuanhuadine는 팥꽃나무의 꽃봉오리 원화에서 추출된 천연 유래 화합물로 AXL 과발현 내성 암종에서 효과적으로 세포사멸을 일으켜 새로운 폐암 내성 극복 항암제로 전임상 연구가 진행 중이다[21]. 표적항암제와 다르게 과발현된 내성 단백질을 분해해 내성의 발생을 초기에 억제할 천연물 유래 항암제로서의 역할이 기대된다.
해양 자원(marine natural products, MNP) 역시 암치료제로서의 연구가 꾸준히 증가하고 있다. MNP는 세포의 성장 저해, antimitotic activity (anti-tubulin effects), apoptosis와 autophagy 유도, migration, invasion 또는 metastasis 억제에 영향을 미친다고 알려진다[22]. 또한 화학적 변동성을 가지고 있어 alkaloids, polyketides, terpenes, peptides, carbohydrates 등의 다양한 형태로의 치료제로 만들 수 있는 장점이 있다. 최근 brentuximab vedotin (adcetris®)의 경우 호지킨 림프종 치료에 쓰이는 연체동물에서 추출한 항체-약물 결합체로 2011년 FDA 승인을 받았고, eribulin mesylate (halaven®)는 해면에서 추출한 유방암 타겟 macrolide계 약물로 2010년 FDA 승인을 받았다. 현재 진행되고 있는 연체동물 및 해면에서 추출한 암종 치료제의 임상 시험은 17종이 넘고 다양한 암종의 치료가 기대된다[22].
2.6 새로운 약물전달시스템의 개발
항암제를 암세포에 전달하는 방식은 약물을 복용하거나 직접 주사하는 방법이나 이는 암세포가 아닌 정상세포에도 약물이 전달되어 정상 세포를 파괴하기도 하고 약물이 암세포 내로 이동이 차단되기도 하여 항암제의 효과를 제대로 발휘할 수 없게 만든다. 따라서 효과적으로 항암제를 특정 암세포에만 전달할 수 있는 시스템 개발이 진행되고 있다.
Death Receptor 5 (DR5)는 tumour necrosis factor receptor (TNFR) family에 속하는 pro-apoptotic 세포 표면 수용체이다. 비임상 시험 결과에 비하여 DR5를 표적으로 하는 약물의 임상연구 결과가 기대에 못 미쳐 약물의 효과를 극대화하기 위한 나노파티클을 이용한 약물의 처리가 연구되었다. Polymer-based nanotherapeutic incorporating both a functionalized polyethylene glycol (PEG) layer에 DR5 항체를 붙여 DR5를 가진 대장암 환자에게 처리 후 효과적인 암세포 사멸을 in vitro 및 in vivo 실험을 통해 확인하였다[23](그림 3).
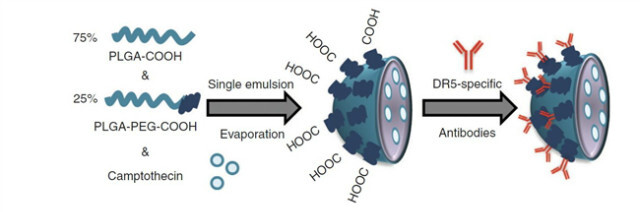
그림 3. DR5표적 나노 기술 제조 모식도[23]
나노테크놀로지의 발전은 유전자 발현을 억제하는 RNA interference (RNAi)를 이용한 암 치료제 개발에도 영향을 미쳤다. 암세포에만 존재하는 특정 유전자나 내성을 유발하는 유전자 발현의 억제를 통해 암을 치료하는 방법으로 그 동안 siRNA의 전달 방법의 한계로 siRNA 치료제 개발은 어려움이 있었다. 흥미롭게도 두 개의 siRNA 시퀀스를 rolling circle tranion (RCT) 반응을 이용해 RNA 폴리머(polymer)를 제조, 이를 콜레스테롤을 이용한 RNA 폴리머의 압축을 통해 나노파티클에 장착한 two-in-one RNA 나노파티클의 제조가 연구되었다[24](그림 4). Two-in-one RNA 나노파티클은 혈액에 안정적으로 전달되며 암세포에 침투하면 siRNA 치료제의 기능을 한다고 알려졌다[24].
바이러스성 전달체를 이용한 연구도 있다. 예를 들면 탄저균의 효율적인 세포 주입 작용을 이용한 항암제 전달 연구이다. 탄저균의 독을 무독성으로 만들어 특정 항체를 세포 안으로 전달하는 방법이다[25]. 이는 기존 항체 약물이 세포막을 통과하여 세포 내로 진입하는데 어려움을 겪던 기존의 문제를 해결해 줄 것이라 기대된다.
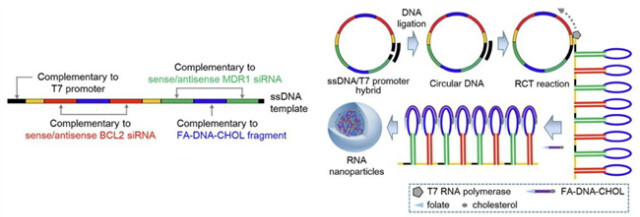
그림 4. RCT 반응을 이용한 two-in-one 나노파티클 제조 모식도[24]
3. 결론
항암제 내성을 극복하기 위한 최신 연구 동향에 대해 살펴보았다. 3세대 항암제인 면역항암제부터 병용요법, 차세대 치료제 및 바이오마커의 개발, 새로운 자원의 개발 및 약물의 전달 시스템 개발 등 다양한 방식으로 항암제 개발이 활발히 진행되고 있다.
첫째, 면역항암제는 현재 가장 활발하게 진행되고 있는 연구 분야로 2010년 이후로 현재 10여 종의 새로운 약물이 FDA 승인을 받았고 또 승인을 기다리고 있다. 이는 환자의 자가 면역 체계를 직접 주입하여 내성의 문제에서 자유로운 이점이 있다. 또한 면역항암제는 개인 맞춤형 치료제로의 개발이 기대된다. 둘째, 환자별 최상의 치료법을 마련하기 위한 맞춤 치료에 활용이 가능한 바이오마커의 경우 기존 약물에 대한 내성 발생의 위험도를 최소화할 수 있는 장점이 있어 면역항암제와 함께 활발하게 연구되고 있는 분야이다. 하지만 현존하는 바이오마커가 약물에 대한 치료 효능이 유전자 변성 등의 이유로 기대에 미치지 못하는 경우가 있어 새로운 바이오마커 개발에 대한 연구도 진행 중이다. 흥미로운 점은 바이오마커의 개발로 환자의 암의 종류에 상관없이 특정 바이오마커의 발현으로 환자를 치료하게 되었다는 점이다. 이는 개인 맞춤 의학(tailored personalized medicine)의 시대까지 도래하게 되었다는 점에서 큰 의미를 가진다. 셋째, 기존 약물의 내성을 극복하기 위한 차세대 약물의 개발이 진행되고 있지만 또 다른 내성의 발생에 대한 부분은 지켜봐야 할 부분이다. 넷째, 병용요법을 통해서 다양한 신호 전달 체계와 상호작용을 통해 항암효과를 거두려는 시도가 진행 중인데 특히 면역항암제와 기존 항암제와의 병용요법은 치료의 효과의 극대화가 기대된다. 다섯째, Paclitaxel, vinblastine, camptothecine 등의 천연물 유래의 항암제는 오랫동안 암 환자를 치료하면서 중요한 역할을 해왔고, 항암제 내성의 발생을 극복하기 위하여 다양한 생물 자원이 항암제 소재로 개발되고 있다. 해양자원의 경우 다양한 화학적 약물을 만들 수 있는 이점이 있는 반면에 현재 승인된 약물이나 임상 시험 약물은 연체동물과 해면이 대부분이다. 좀 더 다양한 해양자원의 개발과 이를 위한 화학적 synthesis의 발전과 기술이 요구된다. 마지막으로 나노파티클을 이용함으로써 성공적인 약물의 전달이나 RNA/DNA와 같은 핵산으로만 구성된 전달체 연구의 중요성이 주목받았다. 또한, 약물전달시스템은 치료와 진단을 함께 할 수 있는 theragnosis 형태로 발전하고 있어 주목할 만한 분야이다.
이렇듯 다양한 항암제 개발 연구는 항암제 내성을 극복하여 궁극적 목표인 암의 치유에 기여할 것으로 기대된다.
출처 : 생물학연구정보센터(BRIC) (바로가기)
'신약개발 소식, 해외 논문들' 카테고리의 다른 글
| 난소암에만 치료약물을 운반하는 나노베지클 개발 (0) | 2022.01.20 |
|---|---|
| SNK01+pembrolizumab(키투르다)(2020년) (0) | 2021.12.03 |
| '항암제 패러다임 바꾼다'...조직불문항암제 주목 (0) | 2021.10.22 |
| 일부 암 환자에게만 효능 보이는 면역항암제 한계 극복했다(나노입자) (0) | 2021.10.22 |
| Asco 2021 – the exon 20 army lines up behind Rybrevant (0) | 2021.10.17 |